- Зависимость скорости реакции от концентрации субстратов
- Зависимость скорости реакции от температуры
- Зависимость скорости реакции от давления
- Зависимость скорости реакции от катализатора
Опыт 1.

В этом эксперименте использовались одинаковые количества магния и одинаковые объемы раствора соляной кислоты. Кислота, используемая в эксперименте B, имеет двойную концентрацию. В то же время в наборе начинает выделяться больше водорода, в котором используется кислота с более высокой концентрацией, что доказывает, что реакции протекают с разными скоростями.
Скорость реакции зависит от концентрации субстратов.
Чем выше концентрация кислоты, тем выше скорость реакции. В представленном эксперименте скорость химической реакции пропорциональна концентрации кислоты.
V = k • [HCl]
Это уравнение называется кинетическим уравнением реакции. k - коэффициент пропорциональности, называемый константой скорости. Константа скорости реакции зависит от типа реакции, зависит от типа реакции и температуры, она не зависит от концентрации реагентов.
Существуют реакции нулевого порядка, что означает, что их скорость не зависит от концентрации субстрата. Знание кинетического уравнения позволяет прогнозировать скорость реакции при различных концентрациях реагентов.
Опыт 2.
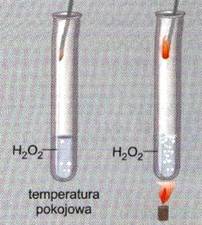
Светящаяся дуга зажигается в пробирке над нагретой перекисью водорода. Количество кислорода в неотапливаемой трубке слишком мало, чтобы зажечь пламя. Увеличение температуры увеличивает скорость реакции. Частота столкновений частиц увеличивается при повышении температуры. Экспериментально установлено, что увеличение температуры на 10 ° C вызывает увеличение скорости реакции в 2-4 раза (говорит правило Вант-Гоффа: если температура реакционной смеси увеличивается на 10 ° C, скорость реакции в этой смеси увеличится в два раза) по мере увеличения значения константы скорости реакция к
Размер этого изменения зависит от типа подложек и диапазона температурных изменений. Повышение температуры на 10 ° С для реакций, происходящих при более низких температурах, приводит к большему ускорению реакции, чем такое же увеличение на более высоких температурных интервалах.
Опыт 3.
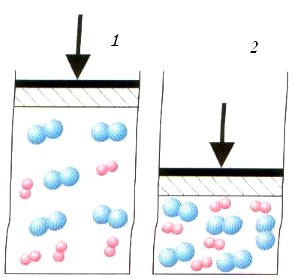
Давление на скорость реакции газовых реагентов оказывает существенное влияние. Увеличение давления вызывает уменьшение объема реакционной смеси. Уменьшение расстояния между молекулами приводит к более частым столкновениям. Реакция в цилиндре 2. происходит быстрее, чем в цилиндре 1.
Чем выше давление, тем выше скорость реакции между газообразными веществами.
Опыт 4.
H2O2 → H2O + O
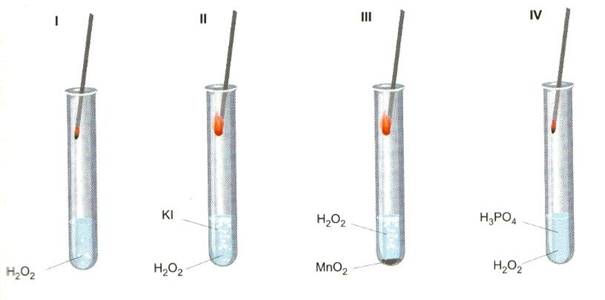
Пробирка наблюдается медленно секреция редкие газовые пузырьки, низкая концентрация которых не способствует пожаротушению. В пробирках II и III реакция протекает быстро, кислород интенсивно выделяется. Светящийся лучник легко воспламеняется. Присутствие KI и MnO2 ускоряет реакцию. В пробирке IV, в которую была добавлена ортофосфорная кислота (V), мы не замечаем никаких признаков протекания реакции. Реакция разложения пероксида водорода была остановлена. H3PO4 вызвал снижение скорости разложения H2O2.
Вещества, использованные в эксперименте: KI, MnO2, H3PO4 изменяют скорость разложения перекиси водорода на воду и кислород.
катализатор это вещество, которое меняет скорость реакции.
Явление изменения скорости реакции под воздействием катализатора называется катализом. Из-за агрегатного состояния различен гомогенный и гетерогенный катализ.
При гетерогенном катализе катализатор обычно имеет постоянное состояние агрегации, а субстраты представляют собой жидкости или газы. Реакция происходит на поверхности катализатора, которая адсорбирует молекулы субстрата, в результате чего связи между атомами в этих молекулах релаксируют. Это облегчает создание продуктов, тем самым ускоряя ход реакции. Скорость реакции зависит, в первую очередь, от скорости диффузии субстратов к катализатору и размера поверхности катализатора.
Гомогенный катализ характеризуется одинаковым состоянием агрегации катализатора и субстратов. Работа катализатора заключается в получении промежуточного продукта, который затем превращается в конечный продукт реакции. Поэтому каждая реакция катализируется многошаговой реакцией.
Катализатор повышает или уменьшает энергию активации реакции. Такие катализаторы, которые увеличивают энергию активации, называются ингибиторами .
Ингибитор замедляет или вызывает торможение химической реакции.
Особый тип катализа - автокатализ . В автокаталитических реакциях катализатор является одним из продуктов реакции. Примером является реакция манганата калия (VII) с оксалатом калия.
2KMnO4 + 5 K2C2O4 + 8H2SO4 → 2MnSO4 + 6K2SO4 + 10CO2 + 8 H2O
Похожие
WLAN роутер: совет по покупке и тестирование... vet-po-pokupke-i-testirovanie-1.jpg" alt="увеличить Текущие WLAN маршрутизаторы: Kaufberatung & большой сравнительный тест"> увеличить Текущие WLAN маршрутизаторы: Kaufberatung & большой сравнительный тест Многие интернет-провайдеры сейчас предлагают тарифы со скоростью загрузки более 100 Мбит / с. Кроме того, увеличивается количество беспроводных устройств в домашней сети, которые
